Interactions entre cellules souches musculaires et leur niche
Nous étudions les cellules souches musculaires squelettiques, en nous intéressant particulièrement aux mécanismes qui maintiennent leur quiescence, à la nature et à la fonction de leur niche extracellulaire, ainsi qu’au rôle de la signalisation Notch.
Pour cela, nous combinons la génétique murine avec des approches moléculaires à haut débit et à l’échelle unicellulaire afin de décrypter les voies de signalisation qui régulent les cellules souches musculaires au cours de la croissance, de l’homéostasie, de la régénération et dans des contextes pathologiques, tels que la dystrophie musculaire. Nos travaux ont contribué à établir le concept d’une niche de quiescence auto-entretenue par les cellules souches et ont identifié Notch comme un régulateur en amont d’un réseau dynamique de matrice extracellulaire. De plus, nous avons développé des protocoles spécialisés pour l’isolement de cellules souches musculaires quiescentes, ce qui nous a permis de mettre en évidence un nouvel état d’activation précoce des cellules souches musculaires et de générer des cartes transcriptionnelles détaillées de la transition de la quiescence à l’activation.
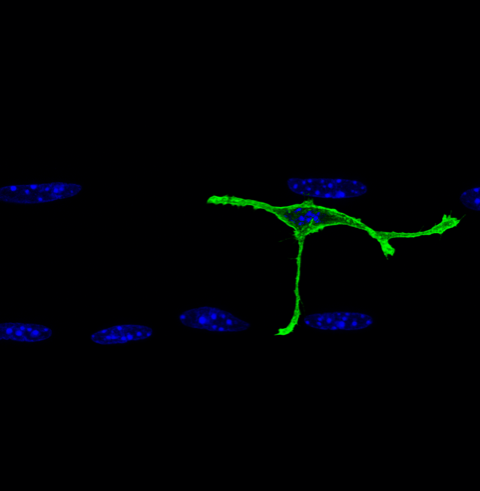
Satellite cell on a myofiber
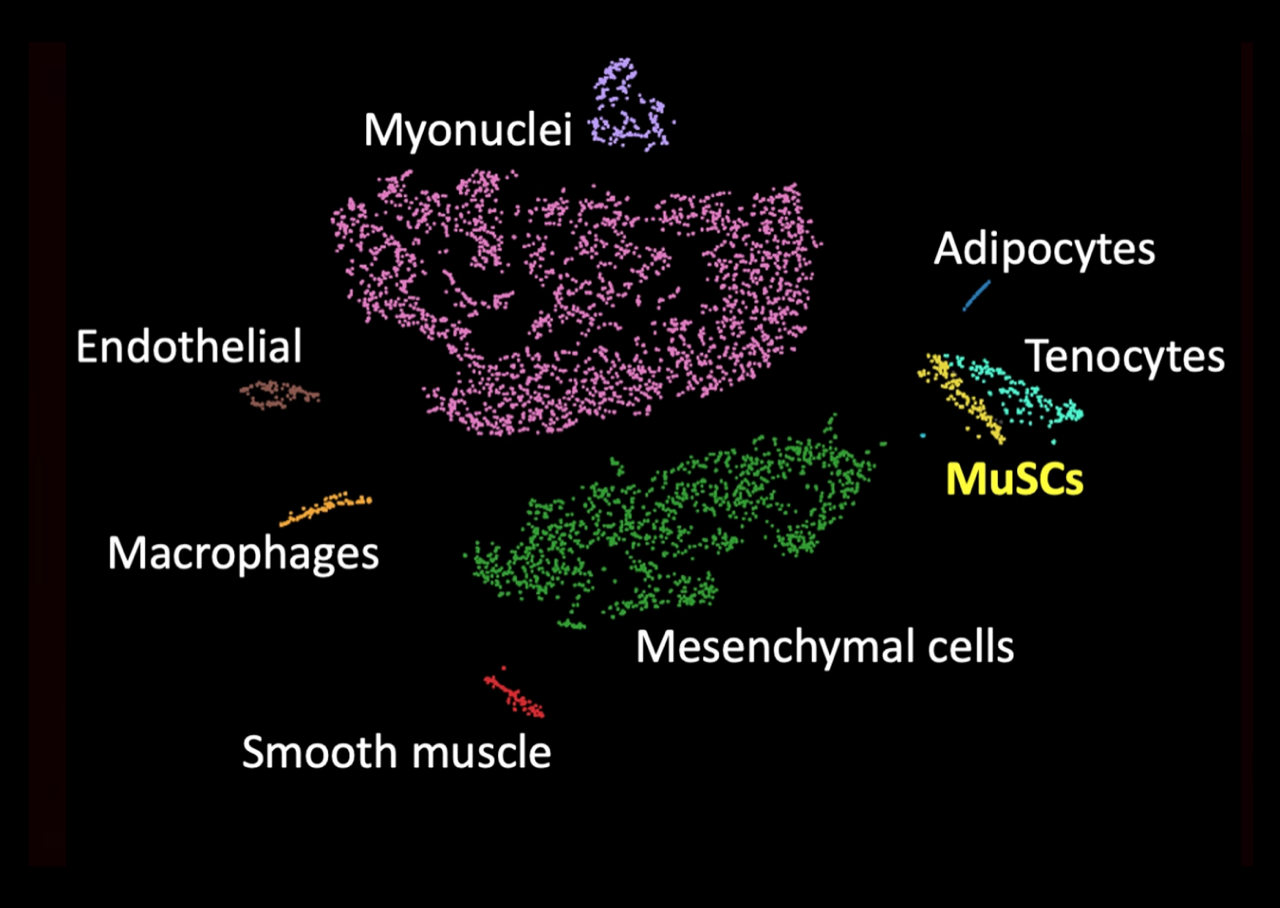
Single-nucleus RNAseq on TA muscle
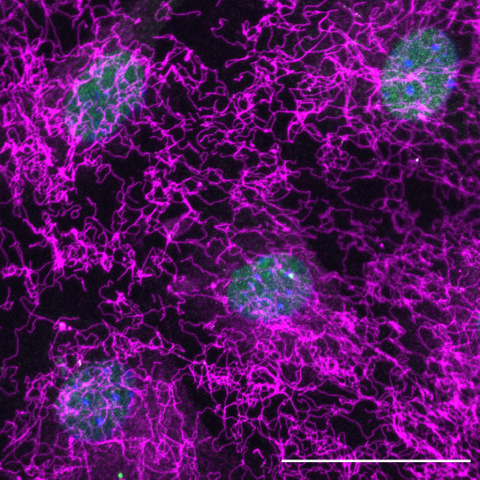
FBN1 expression by NCID myoblasts
Les projets de l’équipe s’articulent autour de trois axes principaux :
Axe 1. Construction de la niche extracellulaire des cellules souches musculaires - Il y a plus de dix ans, nous avons identifié la signalisation Notch comme le premier régulateur de la quiescence des cellules souches musculaires. En combinant des analyses ChIP-seq et transcriptomiques, nous avons mis en évidence de nouvelles cibles de Notch, qui révèlent des mécanismes inédits par lesquels cette voie de signalisation préserve la quiescence. Notre hypothèse de travail est que les cellules souches musculaires jouent un rôle central dans un réseau de matrice extracellulaire indispensable à leur maintien, aussi bien en homéostasie que lors de la régénération musculaire.
Axe 2. Mécanismes contrôlant la quiescence et l’activation des cellules souches musculaires - La capacité du muscle squelettique à se régénérer repose sur des cellules souches musculaires qui sont arrêtées en phase G0 dans un muscle sain. Dans le cadre de nos recherches sur la niche de quiescence et les mécanismes d’activation des cellules souches, nous avons constaté que les méthodes classiques de dissociation cellulaire induisent des modifications transcriptionnelles et épigénétiques rapides et d’une ampleur inattendue. En développant des protocoles spécialisés pour préserver le profil moléculaire des cellules, nous avons identifié des circuits génétiques candidats impliqués dans la régulation des cellules souches musculaires quiescentes et activées.
Axe 3. Origine et fonction des FAPs - En complément des cellules souches musculaires, les progéniteurs fibro-adipogéniques (FAPs) jouent un rôle clé dans l’homéostasie et la régénération musculaire. Ces cellules fibroblastiques mésenchymateuses sont localisées dans l’espace interstitiel entre les fibres musculaires. Cependant, dans des contextes pathologiques comme la dystrophie musculaire de Duchenne, les FAPs prolifèrent et se différencient de manière aberrante, conduisant à une augmentation de la fibrose et des infiltrations graisseuses. En nous concentrant sur la signalisation Notch, nous cherchons à identifier les voies qui régulent la génération et le maintien des FAPs, ainsi que les dysfonctionnements menant à la formation de la fibrose dans des conditions pathologiques.










